IrsiCaixa describe nuevas mutaciones que el VIH utiliza para hacerse resistente a los antirretrovirales
El descubrimiento puede contribuir al diseño de nuevos medicamentos efectivos contra estas regiones del virus y al mismo tiempo ayudar a predecir la efectividad de los tratamientos, proporcionando una medicina más personalizada para las personas con VIH.
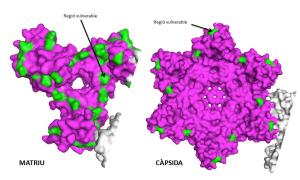
Los inhibidores de la proteasa son una familia de fármacos antirretrovirales que bloquean la proteasa del VIH, una proteína clave en la maduración del virus. Estos medicamentos bloquean la actuación de esta enzima, haciendo que el virus no madure y por tanto no sea infeccioso. Cuando el tratamiento con ellos fracasa, generalmente se debe a que el VIH se hace resistente mutando en unas posiciones muy concretas de la proteasa. Sin embargo, hay pacientes en los que el tratamiento no funciona y en los que no se detectan estas mutaciones. Científicos del Instituto de Investigación del Sida IrsiCaixa han descubierto que esto puede deberse a la aparición de mutaciones en regiones externas a la proteasa, concretamente en las proteínas de unas zonas del VIH llamadas matriz y cápside, y que hasta ahora no se habían identificado. El descubrimiento describe así regiones vulnerables del VIH contra las que diseñar nuevos fármacos. También permitiría anticipar si una persona es portadora de este tipo de virus resistente y adecuar así su tratamiento antirretroviral.
“Durante los últimos años, nos hemos planteado qué ocurre en las zonas del virus externas a la proteasa para que los fármacos no sean efectivos”, explica Julia García Prado, responsable del grupo de Escape Inmunitario y Vacunas (VIRIEVAC) de IrsiCaixa. “Algunos estudios previos describían que había mutaciones fuera de la proteasa involucradas en estos mecanismos de resistencia, y nuestro objetivo era identificar en qué zonas del virus se daban esas mutaciones”, continúa.
Para el estudio, los científicos secuenciaron el ADN de los virus de pacientes tratados con inhibidores de la proteasa durante al menos 9 años, para analizar cómo evolucionaban conjuntamente la proteasa y una proteína estructural del virus llamada gag durante la administración prolongada del fármaco. Esto les permitió identificar regiones del virus implicadas en la adquisición de resistencias a los inhibidores de la proteasa, y que eran “hasta ahora desconocidas, pero importantes”, apunta García Prado.
El estudio mejora el entendimiento básico de cómo funciona el virus y cuáles son sus dinámicas de evolución en presencia de fármacos. Además, puede ayudar a definir zonas vulnerables que permitan el diseño de nuevos fármacos contra la matriz y la cápside del virus, y que aumenten la eficacia del tratamiento antirretroviral. Los inhibidores de la cápside se encuentran actualmente en fases iniciales de desarrollo, y no existe ningún inhibidor de la matriz. “Diseñando inhibidores de la matriz y de la cápside, los virus resistentes a los inhibidores de la proteasa quedarían bloqueados, porque no podrían mutar en estas zonas esenciales para su supervivencia”, concluye García Prado.
Los inhibidores de la proteasa
Los inhibidores de la proteasa son una de las 4 familias de fármacos antirretrovirales que se utilizan hoy en día. Tienen un papel especialmente importante como medicamentos de segunda y tercera línea, administrados a pacientes en los que no han funcionado los fármacos de primera opción. El virus necesita desarrollar diversas mutaciones para hacerse resistente a estos fármacos, mientras que con otras familias basta con una sola mutación.
- Video del programa IrsiCaixa Divulgación – ¿Cómo funcionan los fármacos contra el VIH?